ค่า pH คือการวัดลอการิทึมของความเข้มข้นของไฮโดรเจนไอออนของสารละลายที่เป็นน้ำ pH = -log[H+] โดยที่ log คือลอการิทึมฐาน 10 และ [H+] คือความเข้มข้นของไฮโดรเจนไอออนเป็นโมลต่อลิตร
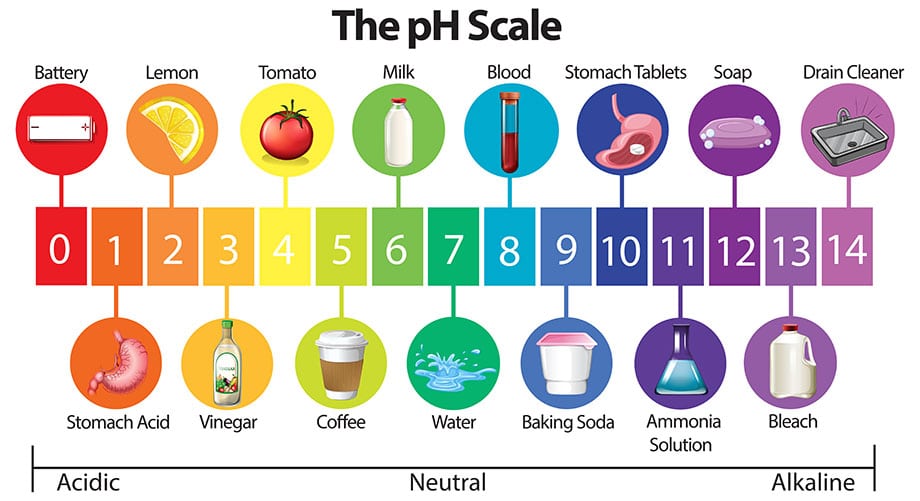
ค่าพีเอชอธิบายความเป็นกรดหรือด่างของสารละลายของเหลวหรือน้ำ โดยที่พีเอชต่ำกว่า 7 เป็นกรดและมากกว่า 7 เป็นด่าง ในขณะที่เท่ากับ 7 ถือว่าเป็นกลาง (เช่น น้ำบริสุทธิ์) โดยปกติค่าพีเอชจะอยู่ในช่วง 0 ถึง 14
แต่หากกรดที่แรงมากสามารถมีค่าติดลบได้ ในขณะที่ด่างที่แรงมากอาจมีค่าเกิน 14 ได้ ซึ่งตรวจวัดได้โดยใช้เครื่องมือวัดพีเอชมิเตอร์
คำว่า “pH” ได้รับการค้นพบครั้งแรกโดยนักชีวเคมีชาวเดนมาร์กชื่อ Søren Peter Lauritz Sørensen ในปีค.ศ. 1909 ค่า pH เป็นตัวย่อของ “พลังของไฮโดรเจน” โดยที่ “p” ย่อมาจากคำว่า power ในภาษาเยอรมัน potenz และ H เป็นสัญลักษณ์ธาตุของไฮโดรเจน .
มาตราส่วน pH
สเกลของค่าพีเอชเป็นแบบลอการิทึม เนื่องจากจะระบุความเข้มข้นของไฮโดรเจนไอออนในสารละลายโดยผกผัน และมีค่าอยู่ในช่วงตั้งแต่ 0 ถึง 14 ซึ่งก็ไม่ถูกต้อง ช่วงพีเอชไม่มีขอบเขตบนหรือล่าง
เนื่องจากตามที่กำหนดไว้ข้างต้น ค่าพีเอชที่เป็นกรดสามารถติดลบได้ และสามารถมากกว่า 14 ได้ ดังนั้นเครื่องวัดรุ่นไหม่สามารถวัดได้กว้าง ตั้งแต่ค่า -2 ไปจนถึง 16 pH
การวัดค่าพีเอชนี้เกี่ยวข้องโดยตรงกับอัตราส่วนของความเข้มข้นของไฮโดรเจนไอออนและความเข้มข้นของไฮดรอกซิลไอออน ([H+] และ [OH-] ตามลำดับ) รายละเอียดทั่วไปของระดับ pH มีดังต่อไปนี้:
- สารละลายเป็นกลาง: pH = 7
- สารละลายกรด: pH <7 (ไม่มี limit ที่ 0 สามารถเป็นค่าติดลบได้)
- สารละลายด่าง: pH > 7 (ไม่มี limit ที่ 14 สามารถมีค่ามากกว่า 14 ได้)
ความเข้มข้นของไฮโดรเจนไอออน
ค่า pH แสดงความเข้มข้นของไฮโดรเจนไอออนของสารละลายในน้ำที่สัมพันธ์กับค่าโมเลกุล เราจะได้มาตราส่วน 10-7 ถึง 10-14 โมล/ลิตร แต่ถ้าเขียนเป็นฟังก์ชันของลอการิทึมลบ จะมีการสร้างมาตราส่วนจริงและเรียบง่ายเป็น 0–14
| H+ Concentration (mole/litre) | OH- Concentration (mole/litre) | pH |
|---|---|---|
| 1 | 0.00000000000001 | 0 |
| 0.1 | 0.0000000000001 | 1 |
| 0.01 | 0.000000000001 | 2 |
| 0.001 | 0.00000000001 | 3 |
| 0.0001 | 0.0000000001 | 4 |
| 0.00001 | 0.000000001 | 5 |
| 0.000001 | 0.00000001 | 6 |
| 0.0000001 | 0.0000001 | 7 |
| 0.00000001 | 0.000001 | 8 |
| 0.000000001 | 0.00001 | 9 |
| 0.0000000001 | 0.0001 | 10 |
| 0.00000000001 | 0.001 | 11 |
| 0.000000000001 | 0.01 | 12 |
| 0.0000000000001 | 0.1 | 13 |
| 0.00000000000001 | 1 | 14 |
มาตราส่วนพีเอชครอบคลุมความเข้มข้นของ H+ ไอออนและ OH- ไอออน ดังนั้นหน่วยวัดค่า pH จึงถูกกำหนดให้เป็นลอการิทึมทั่วไปของความเข้มข้นของไฮโดรเจนไอออนที่ทำงานอยู่ในสารละลายที่เป็นน้ำ

วิธีการที่ใช้ในการวัดค่า pH
กระดาษอินดิเคเตอร์หรือกระดาษวัดค่า pH
การใช้กระดาษเป็นวิธีที่ไม่แพงซึ่งบ่งบอกถึงความเป็นกรดหรือด่างแต่ไม่ใช่การวัดที่แม่นยำ การใช้สีย้อมอินทรีย์ กระดาษเคลือบนี้จะเปลี่ยนสีเพื่อแสดงว่ามีกรดหรือด่าง ใช้งานง่าย กระดาษลิตมัสใช้สำหรับการวัดที่ไม่สำคัญเท่านั้น

สินค้ารุ่นแนะนำคุณภาพสูง
สินค้ากระดาษทดสอบค่ากรด-ด่าง หลายรุ่นสินค้าแบรนด์เยอรมัน พร้อมใบรับรอง Certificate of Calibration
เครื่องวัดค่า pH
พีเอชมิเตอร์เป็นประเภทการวัดที่แม่นยำที่สุดและใช้กันอย่างแพร่หลาย เป็นเครื่องมือที่ใช้ในการวัดความเป็นกรดหรือด่างของสารละลาย หรือเรียกอีกอย่างว่า pH มีสินค้าหลากหลายให้เลือกได้แก่แบบปากกา แบบตั้งโต๊ะ แบบใช้งานภาคสนาม
ด้วยเทคโนโลยีปัจจุบันทำให้มีเครื่องวัดสามารถตรวจวัดกรด-ด่างในของกึ่งแข็งได้เช่นอาหาร เนื้อสัตว์ พริกแกง และดิน ซึ่งเป็นประโยชน์ต่ออุตสาหกรรมในหลายด้าน


สินค้ารุ่นแนะนำคุณภาพสูง
สินค้าเครื่องวัดกรด-ด่างรุ่นแนะนำคุณภาพสูง หลายรุ่นพร้อมใบรับรอง Certificate of Calibration
เหตุใดการวัดค่า pH จึงมีความสำคัญ
ปฏิกิริยาเคมีในน้ำได้รับผลกระทบจากความเป็นกรดหรือด่างของสารละลาย สิ่งนี้สำคัญไม่เพียงแต่ในห้องปฏิบัติการเคมีเท่านั้น แต่ในอุตสาหกรรม การทำอาหาร และยาด้วย ค่า pH ถูกควบคุมอย่างระมัดระวังในเซลล์และเลือดของมนุษย์
ช่วง pH ปกติของเลือดอยู่ระหว่าง 7.35 ถึง 7.45 การแปรผันแม้ไม่มาก อาจถึงแก่ชีวิตได้ ค่าพีเอชของดินมีความสำคัญต่อการงอกและการเจริญเติบโตของพืช ฝนกรดที่เกิดจากมลพิษตามธรรมชาติและที่มนุษย์สร้างขึ้นจะเปลี่ยนความเป็นกรดของดินและน้ำ
ซึ่งส่งผลกระทบอย่างมากต่อสิ่งมีชีวิตและกระบวนการอื่นๆ ในการปรุงอาหาร การเปลี่ยนแปลงค่า pH จะใช้ในการอบและการต้มเบียร์ เนื่องจากปฏิกิริยาหลายอย่างในชีวิตประจำวันได้รับผลกระทบจากค่าพีเอช การรู้วิธีคำนวณและวัดค่าจึงมีประโยชน์



