กรดและด่างมีบทบาทสำคัญในชีวิตและสิ่งแวดล้อมรอบตัวเรา หากคุณเคยชิมน้ำมะนาวหรือล้างมือด้วยสบู่ แสดงว่าคุณเคยเจอกรดและด่าง นักวิทยาศาสตร์จำแนกสารเป็นกรด เบสหรือเป็นกลาง ขึ้นอยู่กับลักษณะเฉพาะ
กรดด่างเป็นสารซึ่งมีปฏิกิริยาระหว่างกันทำให้เกิดเกลือและน้ำ คำว่ากรดมาจากคำภาษาละติน ‘acere’ ซึ่งแปลว่า ‘เปรี้ยว’
นิยามกรดและด่าง
กรดคือสารที่มีไฮโดรเจนซึ่งสามารถให้โปรตอน (ไฮโดรเจนไอออน) แก่สารอื่นได้ เบสคือโมเลกุลหรือไอออนที่สามารถรับไฮโดรเจนไอออนจากกรดได้
สารที่เป็นกรดมักจะระบุด้วยรสเปรี้ยว กรดนั้นโดยพื้นฐานแล้วเป็นโมเลกุลที่สามารถบริจาคไอออน H+ และสามารถคงอยู่ได้หลังจากสูญเสีย H+ กรดจะเปลี่ยนสีกระดาษลิตมัสสีน้ำเงินลิตมัสเป็นสีแดง
สารที่ด่างมีลักษณะเฉพาะที่มีรสขมและเนื้อสัมผัสที่ลื่น เบสที่สามารถละลายในน้ำได้เรียกว่าด่าง เมื่อสารเหล่านี้ทำปฏิกิริยากับกรด จะเกิดเกลือ เป็นที่ทราบกันดีว่าฐานจะเปลี่ยนเป็นกระดาษลิตมัสสีน้ำเงินลิตมัสสีแดง

ความหมายของกรดและด่างในทางเคมี
กรดคือสารที่สร้างไอออนไฮโดรเจน (H+) เมื่อเติมลงในน้ำ ไฮโดรเจนไอออนเป็นเพียงโปรตอนและไม่มีอิเล็กตรอน หากเราดูสูตรของกรดต่างๆ เราจะเห็นว่ากรดเหล่านี้ทั้งหมดมี H (ไฮโดรเจน) อย่างน้อยหนึ่งชนิด ตัวอย่างเช่น
- HCl กรดไฮโดรคลอริก
- H2SO4 กรดซัลฟิวริก
- HNO3 กรดไนตริก
เมื่อเราใส่โมเลกุลของกรดลงไปในน้ำ มันจะแตกตัวออกจากกัน ศัพท์วิทยาศาสตร์สำหรับสิ่งนี้คือการแยกตัวออกจากกัน ตัวอย่างเช่น กรดไฮโดรคลอริก (HCl) แยกตัวออกเป็นไฮโดรเจนไอออน (H+) และแอนไอออนคลอไรด์ (Cl–)
ความแตกต่างทางเคมีระหว่างกรดและเบสคือกรดผลิตไฮโดรเจนไอออนและเบสรับไฮโดรเจนไอออน
ด่างคือสารที่ทำให้กรดเป็นกลาง เมื่อเติมด่างลงในน้ำ จะแตกตัวเป็นไฮดรอกไซด์ไอออน เขียนเป็น OH– เราเรียกเบสที่เติมลงในน้ำว่าเป็นสารละลายอัลคาไลน์
หากเราดูสูตรสำหรับด่างบางสูตร เราจะเห็นว่าทุกสูตรมีไอออนของไฮดรอกไซด์ (OH–) ตัวอย่างเช่น
- NaOH โซเดียมไฮดรอกไซด์ (โซดาไฟ)
- NH4OH สารละลายแอมโมเนียในน้ำ
- Ca(OH)2 แคลเซียมไฮดรอกไซด์ (ปูนขาวสำหรับก่อสร้าง)
หากเติมกรดและเบสเข้าด้วยกัน จะเกิดปฏิกิริยาเป็นน้ำ (H2O) และเกลือ ตัวอย่างที่คุณอาจคุ้นเคยคือการแปรงฟัน กรดที่เกิดจากแบคทีเรียบนฟันของคุณจะทำปฏิกิริยากับเบสในยาสีฟันของคุณ ปฏิกิริยานี้เรียกว่าการวางตัวเป็นกลาง
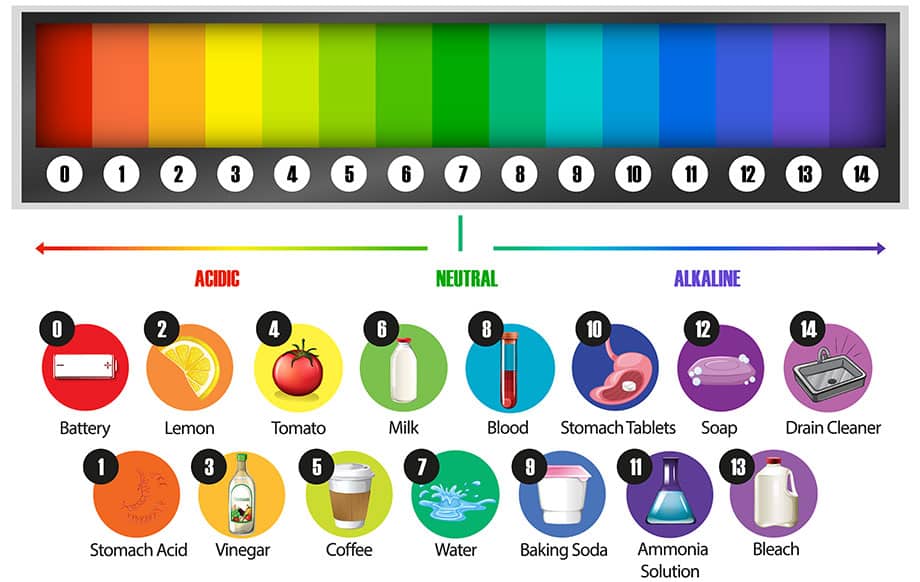
การวัดกรดและด่าง
เครื่องวัดค่า pH จะวัดค่าความเป็นกรดหรือด่างของสารละลาย เมื่อเราทดสอบสารด้วยเครื่องวัดค่า pH เราจะได้ตัวเลขตั้งแต่ 0–14
เป็นมาตราส่วน pH และสามารถใช้เปรียบเทียบสารได้ สิ่งสำคัญคือต้องรู้ว่ามาตราส่วนนี้เป็นลอการิทึม ซึ่งหมายความว่าการลดลงของระดับ pH 1 อาจส่งผลให้ความเข้มข้นของไฮโดรเจนไอออนเพิ่มขึ้น 10 เท่า
กรดมีค่า pH ต่ำกว่า 7 ยิ่ง H+ ไอออน ความเป็นกรดก็จะยิ่งมีค่า pH ต่ำ เบสมีค่า pH สูงกว่า 7 ค่า pH =7 เป็นกลาง ซึ่งหมายความว่ามีความสมดุลของไอออน H+ และ OH– บางครั้ง ค่า pH อาจน้อยกว่า 0 (ติดลบได้) สำหรับกรดที่แรงมาก หรือมากกว่า 14 สำหรับด่างที่แรงมาก


เครื่องมือวัดกรด-ด่าง
ความแม่นยำเป็นสิ่งสำคัญ เรามีเครื่องวัดหลายรุ่นให้เลือกได้แก่วัด pH น้ำ อาหาร เนื้อสัตว์ พริกแกง หลายรุ่นมีใบรับรอง Certificate of Calibration
สรุปเปรียบเทียบระหว่างกรดและด่าง
| รายละเอียด | กรด | ด่าง |
|---|---|---|
| นิยาม | กรดคือสารที่ให้โปรตอน H+ | ด่างคือสารใดๆ ที่รับโปรตอน OH- |
| pH (การวัดความเข้มข้นของไฮโดรเจนไอออนในสารละลาย) | น้อยกว่า 7.0 | มากกว่า 7.0 |
| ลักษณะทางกายภาพ | กรดสามารถเกิดขึ้นได้ทั้งในรูปของแข็ง ของเหลว หรือก๊าซ ทั้งนี้ขึ้นอยู่กับอุณหภูมิ และมีรสเปรี้ยว. | ด่างให้ความรู้สึกลื่นเพราะปฏิกิริยากับน้ำมันในมือ ของแข็งที่พบบ่อย ยกเว้นแอมโมเนียซึ่งเป็นก๊าซ มีรสขม. |
| ความรุนแรง | ขึ้นอยู่กับความเข้มข้นของไฮโดรเนียมไอออน | ขึ้นอยู่กับความเข้มข้นของไฮดรอกไซด์ไอออน |
| คุณสมบัติอื่นๆ | นำไฟฟ้า (เพราะอิเล็กโทรไลต์) ทำปฏิกิริยากับโลหะหลายชนิด | นำไฟฟ้า มีตั้งแต่ไม่ละลายน้ำจนถึงละลายได้จนสามารถทำปฏิกิริยากับไอน้ำได้ |
| การแยกตัว | ไฮโดรเจนไอออน (H+) เมื่อผสมกับน้ำ | ไฮดรอกไซด์ไอออน (OH-) เมื่อผสมกับน้ำ |
| สูตรเคมี | กรดมีสูตรทางเคมีที่มี H อยู่ตอนต้น ตัวอย่างเช่น HCl (กรดไฮโดรคลอริก) มีข้อยกเว้นประการหนึ่งสำหรับกฎของเขา CH3COOH = กรดอะซิติก (น้ำส้มสายชู) | ด่างมีสูตรเคมีที่มี OH ต่อท้าย ตัวอย่างเช่น NaOH (โซเดียมไฮดรอกไซด์) |
| ตัวอย่าง | กรดอะซิติก เช่น CH3COOH และกรดซัลฟิวริก | โซเดียมไฮดรอกไซด์ (NaOH) และแอมโมเนีย (NH3) |
| การเปลี่ยนสีกระดาษลิตมัส | เปลี่ยนสีกระดาษลิตมัสสีน้ำเงินลิตมัสเป็นสีแดง | เปลี่ยนสีกระดาษลิตมัสสีแดงเป็นสีน้ำเงิน |

