ตามแนวคิดดั้งเดิมหรือแนวคิดแบบเก่า รีดิวซ์คือกระบวนการที่เกี่ยวข้องกับการเติมไฮโดรเจนหรือองค์ประกอบอิเล็กโตรโพซิทีฟใดๆ หรือการกำจัดออกซิเจนหรือองค์ประกอบอิเล็กโตรเนกาทีฟใดๆ
ตามแนวคิดในปัจจุบันรีดิวซ์หมายถึงกระบวนการที่อะตอมหรือไอออนได้รับอิเล็กตรอนหนึ่งตัวหรือมากกว่า
ปฏิกิริยารีดิวซ์เกี่ยวข้องกับ:
1. การเติมไฮโดรเจน:
N2 + 3 H2 → 2NH3 (การลดลงของไนโตรเจน)
2. การเติมองค์ประกอบอิเล็กโตรโพซิทีฟ:
SnCl2 + 2HgCl2 → SnCl4 + Hg2Cl2 (การลดลงของเมอร์คิวริกคลอไรด์)
3. การกำจัดออกซิเจน
ZnO + C → Zn + CO (การลดลงของซิงค์ออกไซด์)
4. การกำจัดองค์ประกอบอิเล็กโทรเนกาทีฟ
2FeCl3 + H2 → 2FeCl2 + 2HCl (การลดลงของเฟอร์ริกคลอไรด์)
ตัวรีดิวซ์คือสารที่นำไปสู่การรีดิวซ์ ในตัวอย่างข้างต้น H2, HgCl2 และ C เป็นสารรีดิวซ์
หมายเหตุ: สารที่ผ่านการออกซิเดชันจะทำหน้าที่เป็นตัวรีดิวซ์ในขณะที่สารที่ผ่านการรีดิวซ์จะทำหน้าที่เป็นตัวออกซิไดซ์
การรีดิวซ์ในแง่ของการถ่ายโอนอิเล็กตรอน
ปฏิกิริยาออกซิเดชันและรีดักชันเชื่อมโยงกันเสมอ เนื่องจากอิเล็กตรอนไม่ได้ถูกสร้างขึ้นหรือถูกทำลายในปฏิกิริยาเคมี การเกิดออกซิเดชันและการลดลงมักเกิดขึ้นเป็นคู่ จึงเป็นไปไม่ได้ที่จะมีหนึ่งอิเล็กตรอนโดยไม่มีอีกอิเล็กตรอน ในปฏิกิริยาด้านล่าง แมกนีเซียมจะถูกออกซิไดซ์โดยการสูญเสียอิเล็กตรอนสองตัวไปเป็นออกซิเจน ซึ่งลดลงโดยรับอิเล็กตรอนสองตัวจากแมกนีเซียม

การวัดความสามารถในการรีดิวซ์
Oxidation Reduction Potential (ORP หรือ REDOX Potential) จะวัดความสามารถของระบบน้ำในการปลดปล่อยหรือรับอิเล็กตรอนจากปฏิกิริยาเคมี เมื่อระบบมีแนวโน้มที่จะรับอิเล็กตรอน ก็จะเป็นระบบออกซิไดซ์ เมื่อมันมีแนวโน้มที่จะปล่อยอิเล็กตรอน มันเป็นระบบรีดิวซ์
เมื่อใดจึงจำเป็นต้องมีการวัดค่ารีดอกซ์
มีสาเหตุหลายประการที่ทำให้บางคนต้องการวัดศักยภาพรีดอกซ์ของสารละลาย การตรวจสอบอย่างต่อเนื่องหรือบ่อยครั้งโดยใช้อิเล็กโทรด REDOX อาจมีประโยชน์อย่างมากสำหรับการตรวจจับปัญหาที่เกี่ยวข้องกับการเปลี่ยนแปลงจากสถานะคงที่หรือ “สถานะเสถียร” ของระบบน้ำ
ปฏิกิริยาเหล่านี้สามารถเกิดขึ้นได้จากการปนเปื้อนหรือสารเคมีที่ไม่ต้องการหรือการแทรกแซงจากสิ่งแวดล้อม การใช้งานทั่วไปของการวัด REDOX อีกอย่างหนึ่งคือการวัดการฆ่าเชื้อ ซึ่งสามารถตรวจสอบประสิทธิภาพของการขจัดสิ่งปนเปื้อนและตรวจพบสารฟอกขาวที่ตกค้าง

มาตรส่วน ORP
นิยามการทำงานอย่างง่ายสำหรับ ORP คือความจุของสารละลายสำหรับการถ่ายโอนอิเล็กตรอนที่เรียกว่าออกซิเดชันหรือรีดิวซ์ โดยมีหน่วยเป็นมิลลิโวลต์ ทั้งค่าบวกและค่าลบ
การวัดค่า ORP คือการอ่านค่าศักย์ไฟฟ้าระหว่างอิเล็กโทรดวัดและอิเล็กโทรดอ้างอิง อิเล็กโทรด ORP จะทำหน้าที่เป็นทั้งผู้บริจาคอิเล็กตรอนหรือตัวรับอิเล็กตรอนทั้งนี้ขึ้นอยู่กับวิธีการวัด ORP คล้ายกับ pH โดย pH นั้นบ่งชี้ว่าสารละลายที่เป็นกรดหรือด่างนั้นขึ้นอยู่กับกิจกรรมของไฮโดรเจนไอออนภายในสารละลาย และ ORP ระบุสถานะการเกิดออกซิเดชันของรีดักชันของสารละลายตามกิจกรรมของอิเล็กตรอนร่วมภายในสารละลาย
แสดงในรูปด้านล่างส่วนหนึ่งของมาตราส่วน ORP ทั่วไป โดยทั่วไปช่วงเต็มคือ 1500 mV ถึง -1500 mV อิเล็กโทรด ORP ทั้งหมดได้รับการออกแบบมาเพื่อผลิต 0 mV ที่ pH 7 เช่นเดียวกับ pH เมื่อเราดูที่ระดับ pH กรดถูกกำหนดให้เป็นสารที่มีความสามารถในการปลดปล่อยไฮโดรเจนไอออนและเบสคือสารที่สามารถดูดซับไฮโดรเจนไอออน .
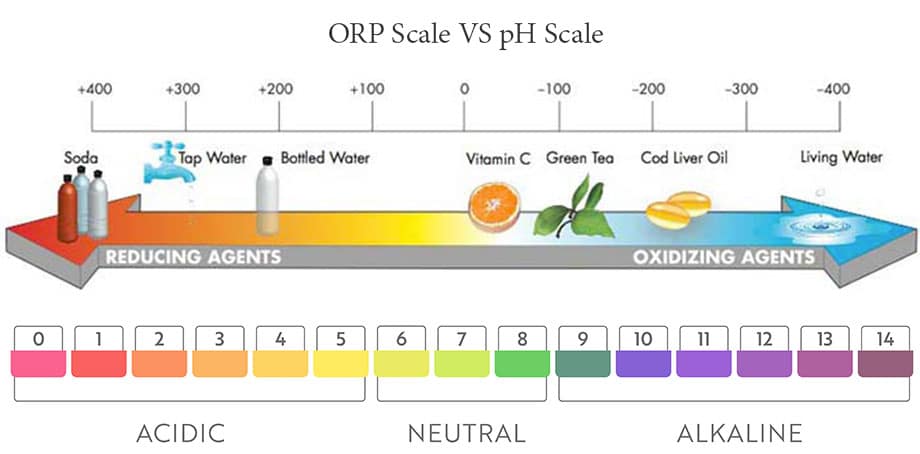
ORP วัดเป็นมิลลิโวลต์ (mV) โดยไม่มีการแก้ไขอุณหภูมิของสารละลาย เช่นเดียวกับค่า pH ORP ไม่ใช่การวัดความเข้มข้นโดยตรง แต่เป็นการวัดระดับกิจกรรม ORP คือการวัดอัตราส่วนของกิจกรรมของชนิดออกซิไดซ์และรีดิวซ์ในสารละลาย ค่า ORP ของวัสดุเฉพาะส่งผลให้มีเอาต์พุต mV บวกหรือลบ ค่าจะถูกกำหนดโดยขนาดของอะตอมของวัสดุและจำนวนอิเล็กตรอนที่พบในเปลือกอิเล็กตรอนชั้นนอก
ในวิชาไฟฟ้าเคมี สมการ Nernst เป็นสมการที่สามารถใช้(ร่วมกับข้อมูลอื่น ๆ นอกจากนี้ยังสามารถใช้เพื่อกำหนดแรงดันไฟฟ้ารวม (แรงเคลื่อนไฟฟ้า) สำหรับระบบได้
สมการ Nernst:
Eh = E0 + RT/nF log (Aox/Ared)
- Eh = คือค่าศักยภาพในการรีดิวซ์หรือการเกิดออกซิเดชันของปฏิกิริยา
- E0 = คือศักย์มาตรฐานเฉพาะของอนุกรมปฏิกิริยาและมีค่าคงที่ ซึ่งไม่ได้รับผลกระทบจาก Aox/Ared อุณหภูมิ ฯลฯ
- RT/nF = คือจำนวน Nernst
- Aox = คือกิจกรรมของสารออกซิไดซ์
- Ared = เป็นกิจกรรมของรีดิวซ์

เครื่องวัดโออาร์พี (REDOX Potential)
ดูรายละเอียดเพิ่มเติมเครื่องมือวัด Redox ในหน่วยมิลลิโวลท์ mV คุณภาพสูง หลายรุ่นพร้อมใบรับรอง Certificate

