เราได้ยินคำศัพท์เช่นการเกิดออกซิเดชันและการรีดักชั่นในวิชาเคมี การเกิดออกซิเดชันคือปฏิกิริยาเคมีที่เกี่ยวข้องกับการถ่ายโอนอิเล็กตรอนจากสารเคมีหนึ่งไปยังอีกสารหนึ่ง ปฏิกิริยาการถ่ายเทอิเล็กตรอนเหล่านี้เรียกว่าปฏิกิริยาออกซิเดชันหรือปฏิกิริยารีดอกซ์ ปฏิกิริยาเหล่านี้มาพร้อมกับการเปลี่ยนแปลงพลังงานในรูปของความร้อน แสง และไฟฟ้า เป็นต้น
นิยามการออกซิเดชัน
ตามแนวคิดคลาสสิกหรือแนวคิดดั้งเดิมการเกิดออกซิเดชันเป็นกระบวนการที่เกี่ยวข้องกับ
- การเติมออกซิเจน
- องค์ประกอบอิเล็กโตรเนกาทีฟใดๆ
- การกำจัดไฮโดรเจนหรือองค์ประกอบอิเล็กโตรโพซิทีฟใดๆ
ตามแนวคิดทางใหม่การเกิดออกซิเดชันคือ
- การสูญเสียอิเล็กตรอนระหว่างปฏิกิริยาของโมเลกุล อะตอม หรือไอออน
การเกิดออกซิเดชันเกิดขึ้นเมื่อสถานะออกซิเดชันของโมเลกุล อะตอม หรือไอออนเพิ่มขึ้น กระบวนการตรงข้ามเรียกว่าการรีดักชัน ซึ่งเกิดขึ้นเมื่อมีการเพิ่มของอิเล็กตรอนหรือสถานะออกซิเดชันของอะตอม โมเลกุล หรือไอออนลดลง
ปฏิกิริยาออกซิเดชันเกี่ยวข้องกับ:
1. การเติมออกซิเจน:
C + O2 → CO2 (ออกซิเดชันของคาร์บอน)
2. การเพิ่มองค์ประกอบอิเล็กโตรเนกาทีฟ:
Fe + S → FeS (ออกซิเดชันของเหล็ก)
3. การกำจัดไฮโดรเจน:
H2S + Br2 → 2 HBr + S (ออกซิเดชันของซัลไฟด์)
4. การกำจัดองค์ประกอบไฟฟ้า:
2 KI + H2O2 → I2 + 2 KOH (ออกซิเดชันของไอโอไดด์)
การเกิดออกซิเดชันในแง่ของการถ่ายโอนอิเล็กตรอน
นี่คือคำจำกัดความของการเกิดออกซิเดชันที่ใช้กันมากที่สุดและใช้ได้อย่างกว้างขวางที่สุด ในกรณีนี้ Oxidation คือการสูญเสียอิเล็กตรอน และรีดักชั่นคือการเพิ่มของอิเล็กตรอน
ปฏิกิริยาออกซิเดชันและรีดักชันเชื่อมโยงกันเสมอ
เนื่องจากอิเล็กตรอนไม่ได้ถูกสร้างขึ้นหรือถูกทำลายในปฏิกิริยาเคมี การเกิดมักเกิดขึ้นเป็นคู่ จึงเป็นไปไม่ได้ที่จะมีหนึ่งอิเล็กตรอนโดยไม่มีอีกอิเล็กตรอน ในปฏิกิริยาด้านล่าง แมกนีเซียมจะถูกออกซิไดซ์โดยการสูญเสียอิเล็กตรอนสองตัวไปเป็นออกซิเจน ซึ่งลดลงโดยรับอิเล็กตรอนสองตัวจากแมกนีเซียม

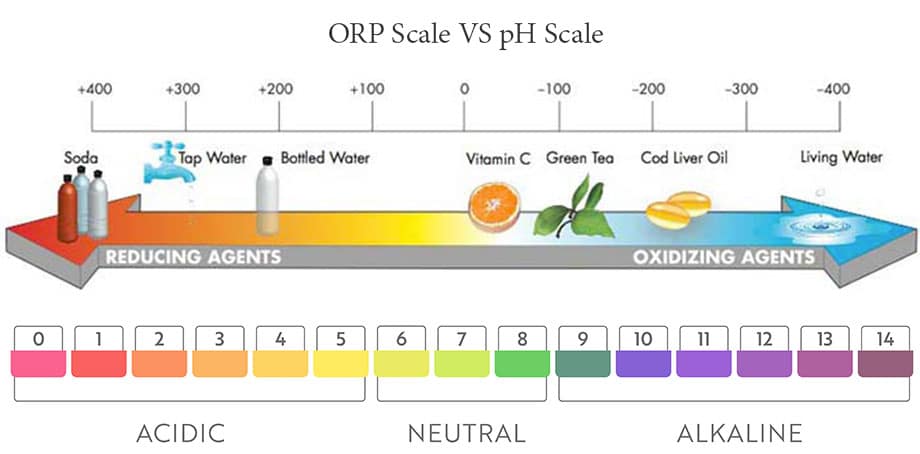
การตรวจวัดการเกิดออกซิเดชันและรีดักชัน
ORP (Oxidation-Reduction Potential) คือการวัดในหน่วยมิลลิโวลต์ของความจุของสารละลายสำหรับการถ่ายโอนอิเล็กตรอน (ออกซิเดชันหรือรีดักชัน) การวัดค่า ORP อาจเรียกอีกอย่างว่า REDOX สำหรับ REDuction OXidation ชื่อนี้สะท้อนความจริงที่ว่าภายในปฏิกิริยาเคมีรีดักชันและการเกิดออกซิเดชันอย่างใดอย่างหนึ่ง
ด้วยปฏิกิริยารีดอกซ์ เราพูดถึงจุดแข็งของตัวออกซิไดซ์และตัวรีดิวซ์ สารออกซิไดซ์มีความสามารถหรือศักยภาพในการรับอิเล็กตรอนและลดลง การลดลงหมายถึงการเพิ่มของอิเล็กตรอนโดยอะตอมทำให้สถานะออกซิเดชันของธาตุลดลง
Cu2+ + 2e– → Cu
ตัวรีดิวซ์บริจาคอิเล็กตรอนและกลายเป็นออกซิไดซ์ ออกซิเดชันหมายถึงการสูญเสียอิเล็กตรอนจากอะตอมทำให้สถานะออกซิเดชันของธาตุเพิ่มขึ้น
Fe → Fe2+ + 2e–
นิยาม ORP (Oxidation-Reduction Potential)
นิยามการทำงานอย่างง่ายสำหรับ ORP คือความจุของสารละลายสำหรับการถ่ายโอนอิเล็กตรอนที่เรียกว่าออกซิเดชันหรือรีดักชั่น โดยตรวจวัดเป็นมิลลิโวลต์ (mV) ทั้งค่าบวกและลบ
การวัดค่า ORP คือการอ่านค่าศักย์ไฟฟ้าระหว่างอิเล็กโทรดวัดและอิเล็กโทรดอ้างอิง อิเล็กโทรด ORP จะทำหน้าที่เป็นทั้งผู้บริจาคอิเล็กตรอนหรือตัวรับอิเล็กตรอนทั้งนี้ขึ้นอยู่กับวิธีการวัด ORP คล้ายกับ pH
โดย pH นั้นบ่งชี้ว่าสารละลายที่เป็นกรดหรือด่างนั้นขึ้นอยู่กับกิจกรรมของไฮโดรเจนไอออนภายในสารละลาย และ ORP ระบุสถานะการเกิดออกซิเดชันของรีดักชันของสารละลายตามกิจกรรมของอิเล็กตรอนร่วมภายในสารละลาย
แสดงในรูปเป็นส่วนหนึ่งของมาตราส่วน ORP ทั่วไป โดยทั่วไปช่วงเต็มคือ 1500 mV ถึง -1500 mV อิเล็กโทรด ORP ทั้งหมดได้รับการออกแบบมาเพื่อผลิต 0 mV ที่ pH 7 เช่นเดียวกับ pH เมื่อเราดูที่ระดับ pH กรดถูกกำหนดให้เป็นสารที่มีความสามารถในการปลดปล่อยไฮโดรเจนไอออนและเบสคือสารที่สามารถดูดซับไฮโดรเจนไอออน .
- การอ่านค่า ORP ที่เป็นค่าบวกหมายความว่าสารนี้เป็นสารออกซิไดซ์
- การอ่านค่าลบแสดงว่าสารเป็นตัวรีดิวซ์